RESUMEN
Introducción: El
lisado plaquetario es una terapia celular que contribuye a la reparación de
tejidos dañados; su utilización en el tratamiento de fracturas expuestas es muy
reciente y de escasa publicación. Objetivo: describir la evolución de un
paciente con fractura expuesta del primer dedo del pie en el que se utilizó el
lisado. Presentación de caso: paciente que sufrió trauma con arma
blanca. Se realizó diagnóstico clínico y radiológico de fractura expuesta tipo
II, por lo que realizó proceder quirúrgico. Posterior a la cirugía el paciente
evolucionó de forma desfavorable, presentando una infección profunda de la
herida quirúrgica. Se decidió realizar la infiltración profunda con lisado
plaquetario, complementado con la aplicación de este último en forma de
cataplasma. Después de 14 días de tratamiento se obtuvo un adecuado resultado,
el paciente se reincorporó a su actividad habitual a los 6 meses de iniciada
esta terapia celular. Conclusiones: ante un caso con fractura expuesta y
lesiones infectadas de partes blandas, la utilización del lisado plaquetario
acelera el proceso de cicatrización y granulación de tejidos y facilita la
reincorporación del paciente a su vida social y laboral.
Palabras
clave: fractura expuesta; lisado plaquetario; ortopedia; plasma
______________________________ABSTRACT
Background: Platelet
lysate is a cellular therapy that contributes to the repair of the damaged
tissues; its use in the treatment of open fractures is very recent and its
study poorly disseminated. Objective: to describe the evolution of a
patient with an open fracture of the first toe using the lysate. Case
presentation: A patient who suffered a knife wound. The clinical and
radiological diagnosis of a type II open fracture was made, accordingly the
surgical procedure was performed. After surgery, the patient evolved
unfavorably, presenting a serious infection of the surgical wound. Deep
infiltration was performed with complementary platelet lysate with the
application of the latter in the form of a poultice. After 14 days of
treatment, a satisfactory result was obtained. The patient returned to his
usual social routine 6 months after starting this cell therapy. Conclusion:
In a case with an open fracture and infected soft tissue lesions, the use of
platelet lysate accelerates the healing process and tissue granulation and
facilitates the patient's reincorporation to his social and working life.
Keywords:
Open Fracture; Platelet Lysate;
Orthopedics; Plasma.
INTRODUCCIÓN
ara el tratamiento de las fracturas expuestas
existe un protocolo desde el momento de ocurrida la lesión hasta la aparición
de secuelas o complicaciones, donde se cuenta con un arsenal terapéutico
durante todo el proceso. Este protocolo delimita las acciones a realizar desde
la llegada del paciente a cuerpo de guardia en las medidas de sostén
encabezadas por el ABC de atención a pacientes politraumatizados, su posterior
intervención quirúrgica de urgencia, en el que se delimita la atención a las
partes blandas, el hueso y su estabilización además del tratamiento
farmacológico en sala y por último, el tratamiento definitivo en dependencia
de su evolución (Campbell, James y Daniels, 2006).
El uso de clasificaciones es importante
porque permite comparar las estadísticas entre distintos cirujanos para la
realización de publicaciones científicas. Además la clasificación de las
fracturas abiertas, nos brinda una guía con respecto al pronóstico y método de
tratamiento a utilizar. Existen varias clasificaciones, pero la mundialmente
aceptada es la de Gustillo y Anderson, publicada en el año 1976 y
posteriormente modificada por Gustillo en el año 1984 (como se citó en
Campbell, James y Daniels, 2006).
Los factores más importantes en esta
clasificación lo constituyen: el daño de las partes blandas, el grado de
contaminación y la longitud de la herida, que por sí sola, no es un factor
decisivo para la aplicación de la clasificación.
Es muy importante aclarar que el momento de
aplicar la clasificación de las fracturas, es después del primer desbridamiento
en el salón, pues de esta manera se conoce la verdadera extensión de la lesión.
Tipo I: la herida es producida de
adentro hacia fuera por el hueso, hay poco sangramiento. Al explorarse se
comprueba la verdadera clasificación.
Tipo II: son causadas por traumas de
moderada energía, y usualmente la herida es mayor de 1 cm. La dirección de la fractura
es de fuera a dentro. Puede encontrarse alguno que otro tejido necrótico, pero la necesidad de desbridamiento es de
mínima a moderada y usualmente limitada a un solo compartimento. El cierre de
la herida es generalmente posible sin la necesidad de injerto de piel.
Tipo III: son causadas por un trauma
de alta energía. Son fracturas generalmente desplazadas, conminutas y muy
contaminadas. Existen algunas situaciones en que las fracturas se incluyen en
el grado III independientemente del tamaño de la herida como son: fracturas
causadas por arma de fuego, fracturas segmentarias, fracturas diafisiarias con
pérdida de sustancia ósea, fractura con daño vascular asociado que necesita
reparación, presencia de síndrome compartimental asociado y fracturas que ocurren
en lugares extremadamente contaminados, como son los corrales de animales.
Las fracturas tipo III a la vez son subdivididas en 3 subtipos
como son:
III-A: existe afección del periostio y
partes blandas, pero esta permite la cobertura adecuada del hueso por músculos,
tendones y estructuras neurovasculares.
III-B: ocurre muy similar al tipo A,
pero en esta ocasión para realizar la cobertura ósea se necesita realizar algún
proceder de cirugía plástica reconstructiva.
III-C: esta variedad se caracteriza por
la presencia de daño vascular que necesita de reparación. Cuando ocurre daño de
la arteria tibial anterior, pero se preserva la tibial posterior, no se
considera tipo III-C. (Campbell, James y Daniels, 2006).
Existen otros factores que modifican la clasificación
independientemente del tamaño de la herida, los cuales son:
-Contaminación: exposición al suelo, agua contaminada, flora oral,
contaminación marcada a la inspección y retardo en el tratamiento mayor de 12
h.
-Signos que demuestran la presencia de un mecanismo de producción
de alta energía: Fracturas segmentarias, pérdida de sustancia ósea, síndrome
compartimental, pérdida extensiva de piel y tejido celular subcutáneo.
IRRIGACIÓNY DESBRIDAMIENTO
El primer paso es ampliar la herida para identificar el tejido
blando y óseo dañado. En ocasiones, es necesario realizar fasciotomías
limitadas a un compartimento muscular para determinar la viabilidad de estos.
El tejido necrótico puede causar problemas sistémicos potenciales, como:
mioglobinuria y fallo renal además de la complicación local dada por la
infección.
La importancia de la irrigación abundante de la herida, donde se
recomienda el uso al menos de diez litros de solución salina para la
irrigación, está en las fracturas abiertas y cumple con 2 frases fundamentales:
"si solo un poco hace bien, cuando es mucho es mejor" y "la
solución de la contaminación es la dilución".
ANTIBIÓTICOS
El uso de antibióticos desempeña una función crucial en el manejo
de las fracturas abiertas. La selección del antibiótico depende del germen
encontrado con mayor frecuencia en los estudios microbiológicos. Cuando se
sospecha contaminación mixta por gérmenes grampositivos y gramnegativos, se
debe indicar una terapia antibiótica contra estos patógenos de forma combinada.
El antibiótico sistémico utilizado con más popularidad en la actualidad son las
cefalosporinas de primera generación y como ejemplo clásico se encuentra la
cefazolina, la cual es efectiva contra gérmenes grampositivos. Si sospechamos
contaminación por gramnegativos debe agregar al tratamiento el uso de
aminoglucócidos como gentamicina o tobramicina.
La terapia antibiótica debe comenzar lo antes posible, sin
embargo, el tiempo de duración constituye un tema controversial en la
actualidad. La mayoría de los autores coinciden en que el tiempo mínimo de
utilización es de 3 días para las fracturas tipo I y II y de 5 días para las
fracturas tipo III. El tratamiento puede prolongarse o no en dependencia del
tipo de fractura y su comportamiento en los desbridamientos sucesivos.
MÉTODOS DE ESTABILIZACIÓN ÓSEA
Una vez realizada la irrigación, el desbridamiento, uso de
antibiótico y decisión de conservar la extremidad, el próximo paso es la
estabilización ósea.
Los autores consideran que mientras más severa e inestable es la
fractura, es más necesaria la estabilización ósea.
Los objetivos de estabilización ósea independientemente del método
a utilizar son los siguientes:
- Restaurar la longitud y alineación ósea normal.
- Restaurar la superficie articular desplazada por la fractura.
- Permitir el acceso a las partes blandas traumatizadas.
- Facilitar los procederes de reconstrucción posteriores.
- Facilitar la unión de la fractura.
- Permitir la rápida función de la extremidad.
La selección del método de fijación depende del tipo de fractura,
localización y daño asociado de las partes blandas. Los métodos de
estabilización son los siguientes: inmovilización enyesada, tracción
esquelética, fijación intramedular, fijación externa y uso de placas AO.
Inmovilización enyesada: es de uso
limitado en el tratamiento de las fracturas abiertas, sin embargo puede ser
utilizada en fracturas tipo I no desplazadas.
Tracción esquelética: se utiliza solo
como método transitorio mientras el paciente espera por el tratamiento
definitivo.
Fijación intramedular: se prefiere por
gran número de cirujanos ortopédicos para el manejo de las fracturas abiertas
tipo I, II y III-A según reporta Bhandari. En las fracturas tipo III-B existe
un uso mayor de fijación externa que el intramedular. La eficacia de la
fijación intramedular en las fracturas no muy contaminadas es que presentan un
índice de consolidación similar a la fijación externa sin las aplicaciones de
esta como es la infección de los pines.
Fijación externa: es un método
rápido y fácil de aplicar; permite una rápida movilización y rehabilitación
especialmente en pacientes politraumatizados; permite la aplicación de curas a
repetición; constituye un método definitivo o transitorio; para su aplicación
solo se pierde una mínima cantidad de sangre y es aplicado en un sitio distante
a la fractura.
MANEJO DE LA HERIDA
Con respecto al cierre de la herida, el manejo puede ser de 3
maneras: primario, retardado, dejar la herida abierta y luego realizar un proceder
de cirugía plástica reconstructiva.
El cierre primario está justificado solo en las siguientes
situaciones:
- Herida limpia o pobremente contaminada.
- Cuando todo el tejido necrótico y los cuerpos extraños han sido
eliminados.
- Circulación arterial y venosa de la extremidad normal.
- Estructuras neurológicas intactas.
- Condición satisfactoria del paciente permite los cuidados
posoperatorios.
- La herida puede ser cerrada sin tensión.
- El cierre no permite la presencia de espacio muerto.
- Ausencia de daño multisistémico.
Para la realización del cierre primario se necesita valorar a
profundidad todas las situaciones, de lo que depende en gran medida la
experiencia del cirujano. El mayor riesgo de cierre primario es la infección
por gérmenes anaerobios que pueden causar gangrena gaseosa. Si el cirujano no
está seguro de que el paciente reúne todos los requisitos para este tipo de
cierre es mejor optar por dejar la herida abierta.
El cierre retardado de la herida también conocido con el término
de cierre primario retardado, se realiza generalmente alrededor del quinto día
de producida la fractura. La ventaja de este método es que minimiza la
posibilidad de infección por anaerobios y esta espera de 5 días le permite al
paciente movilizar sus defensas locales. Este proceder se justifica, pues
algunos autores plantean que la incidencia de infección después del quinto día
es causada por gérmenes nosocomiales.
Cuando existen grandes posibilidades del desarrollo de infección
debido al grado de contaminación, lesión ósea y de partes blandas, es
preferible dejar la herida abierta. Posteriormente, si el cierre de la herida
de borde a borde, no es posible, se indican otros procederes como la
realización de incisiones que permitan la traslación de la piel y el uso de
injertos de piel (Campbell, James y Daniels, 2006).
La terapia celular se perfila como una de las
técnicas más prometedoras del futuro arsenal médico para la reparación de
tejidos destruidos o con daños. En la última década, en Cuba tiene lugar una
verdadera revolución regenerativa donde el lisado plaquetario (LP) es una de
ellas, proporcionando propiedades reparadoras y regenerativas de los tejidos
dañados (Carrillo Mora, González Villalva, Macías-Hernández y Pineda
Villaseñor, 2018).
La importancia y significación de este caso
descansa en el reto que impuso salvar el primer dedo del pie del paciente, por
la importancia que reviste este en la sostenibilidad del arranque de la marcha,
por la gran pérdida de tejidos blandos y el poco tiempo del que se dispone para
que las estructuras óseas no presenten un daño irreversible y no tener que
llegar a la amputación. Sin otras alternativas quirúrgicas viables que
ofrecieran una adecuada cobertura del hueso, se toma la decisión de aplicar la
técnica de lisado plaquetario para acortar el tiempo de granulación de los
tejidos y contar con una adecuada cobertura para las estructuras óseas.
En Cuba y en la provincia de Sancti Spíritus
hay pocos casos reportados en la literatura científica donde se utilice el LP
en fracturas expuestas. En otros estudios los resultados obtenidos han sido
satisfactorios, aunque el mayor empleo de esta terapia se reporta en su
utilización como cataplasma sobre las lesiones en las partes blandas, también
se reportan casos en la utilización de LP para la estimulación del callo óseo y
en los retardos de la consolidación ósea asociado en ocasiones a fracturas
expuestas, con un aporte significativo en la disminución de la estadía
hospitalaria al acelerar los procesos de granulación y cicatrización de los
tejidos. (Carrillo Mora, et al. 2018).
Las plaquetas son elementos sanguíneos anucleados, derivados de la
fragmentación de sus células precursoras: los megacariocitos. Tienen forma de
disco biconvexo de 2-3 µm de diámetro, su concentración normal en sangre
periférica es de 150 a 400 x 109/L y su vida media es de entre 7 y
10 días.
Las
características estructurales y funcionales de las
plaquetas ha sido un tema de gran interés científico, que se ha mantenido con
el paso de los años y ha permitido adquirir progresivamente nuevos
conocimientos sobre estos importantes elementos sanguíneos (Carrillo Mora, et
al. 2018).
El estudio de la morfología de las plaquetas se facilitó con la
aplicación de la microscopía óptica, pero los mayores avances se obtuvieron
tiempo después con la introducción de la microscopía electrónica,
fundamentalmente la de transmisión, que permitió una mejor caracterización de
la estructura plaquetaria. El conocimiento de los elementos ultraestructurales
visualizados en las plaquetas, ha dado la posibilidad de correlacionarlos con
algunas de sus funciones e ir descubriendo progresivamente el secretoma
plaquetario.
La membrana externa que recubre las plaquetas se ha llamado
glicocáliz, por su riqueza en glicoproteínas, tanto derivadas de la propia
membrana como absorbida del plasma. Debajo de esta membrana hay una banda
circundante de microtúbulos, que entre otras funciones tiene la de contribuir a
estabilizar la estructura normal. En la zona periférica externa submembranosa y
mediante el empleo de algunas coloraciones especiales, se pueden ver en las
plaquetas en reposo, algunos microfilamentos de actina.
Entre las estructuras membranosas también se incluye el sistema
canalicular abierto, que se comunica directamente con el exterior y por donde
se emite la secreción de los productos solubles plaquetarios. Con frecuencia,
cerca de este sistema se puede ver el sistema tubular denso, estructura
membranosa en la que se desarrolla el metabolismo intraplaquetario del ácido
araquidónico.
En el citosol de las plaquetas se pueden identificar distintos
tipos de inclusiones, entre ellas, los gránulos alfa y los densos. Los primeros
son estructuras grandes, ricas en macromoléculas, constituyen el 15 % del
volumen total de la plaqueta; además, contienen glicoproteínas y moléculas de
adhesión. Tienen una participación importante en la interacción entre las
plaquetas y son determinantes en la función plaquetaria. La liberación de su
contenido permite también su participación en la interacción con otras células
y en los mecanismos de la regeneración hística.
Los gránulos densos son estructuras con una zona periférica
electro-clara, que con frecuencia les da una imagen que algunos han llamado
"ojos de buey". Estos gránulos tienen un elevado contenido de calcio
y fósforo inorgánico, lo que les confiere una alta densidad electrónica.
También contienen ADP, ATP y serotonina (Carrillo Mora, et al. 2018).
En el interior de las plaquetas se pueden identificar además,
gránulos de glucógeno, mitocondrias y ocasionalmente lisosomas y peroxisomas.
Estos últimos tienen una morfología heterogénea y en ocasiones puede observase
en su interior una formación poliédrica secundaria a la cristalización de
proteínas. Durante el proceso de la activación plaquetaria se secretan todas
las sustancias granulares (Hernández Ramírez, 2011).
Diversas han sido las investigaciones que se han realizado sobre
la estructura y el funcionamiento de las plaquetas, actividad que ha adquirido
un gran impulso en los últimos años, no solo porque son factores fundamentales
en la cascada de eventos que participan en la hemostasia, sino también porque
se ha ido conociendo cada vez más, que estas constituyen una importantísima
fuente de factores bioactivos, que intervienen de forma destacada en la
regeneración y reparación de distintos tejidos del organismo.
Las plaquetas contienen múltiples proteínas que ejercen acciones
sobre diferentes aspectos de la reparación tisular. Actualmente, son
consideradas como una bomba o coctel de moléculas bioactivas (factores de
crecimiento, citocinas, quimiocinas y otras moléculas, incluso algunas aún no
descritas) y proteínas en proporciones fisiológicas. La hipótesis de que los
factores solubles liberados por las células madre, implantadas con fines
regenerativos, desempeñan una acción importante en la reparación y regeneración
de los tejidos y las ventajas del uso de las plaquetas como fuente de FC, han
sido señaladas en los últimos años.
Las plaquetas, fragmentos citoplasmáticos de
los megacariocitos, tienen una vida media que oscila entre 8 y 12 días. Además
de su intervención en la hemostasia, estas son reconocidas como una importante
fuente natural de factores de crecimiento (FC).
Otros FC producidos por las plaquetas y
asociados con los procesos regenerativos incluyen: factor de crecimiento básico
del fibroblasto, factor de crecimiento-1 asociado con la insulina, factor de
crecimiento epitelial (EGF, del inglés epidermalgrowth factor), factor
de crecimiento del hepatocito y el factor de crecimiento del endotelio vascular
(VEGF, del inglés vascular endotelial growth factor). La aplicación
local de altas concentraciones de estos FC mediante el uso de plasma rico en
plaquetas (PRP) ha sido utilizada con anterioridad y recientemente, del
concentrado de plaquetas (CP), con la finalidad de acelerar el proceso curativo
de diferentes lesiones.
Las plaquetas, fragmentos citoplasmáticos de
los megacariocitos, tienen una vida media que oscila entre 8 y 12 días. Además
de su intervención en la hemostasia, estas son reconocidas como una importante
fuente natural de factores de crecimiento (FC) (Hernández Ramírez, 2011).
Los componentes de los gránulos plaquetarios,
que se liberan durante su activación, influyen sobre otras células. Uno de
ellos es el factor de crecimiento derivado de la plaqueta (PDGF, del inglés plateletderivedgrowth
factor), potente agente quimiotáctico que estimula la proliferación
celular. Por otra parte, el factor de crecimiento transformante beta, estimula
el depósito de matriz extracelular. Ambos factores han demostrado desempeñar
una actividad significativa en la regeneración y reparación del tejido
conectivo (Hernández Ramírez, 2011).
Otros FC producidos por las plaquetas y
asociados con los procesos regenerativos incluyen: factor de crecimiento básico
del fibroblasto, factor de crecimiento-1 asociado con la insulina, factor de
crecimiento epitelial (EGF, del inglés epidermalgrowth factor), factor
de crecimiento del hepatocito y el factor de crecimiento del endotelio vascular
(VEGF, del inglés vascular endotelial growth factor). La aplicación
local de altas concentraciones de estos FC, mediante el uso de plasma rico en
plaquetas (PRP), ha sido utilizada con anterioridad y recientemente del
concentrado de plaquetas (CP), con la finalidad de acelerar el proceso curativo
de diferentes lesiones (Carrillo Mora, et al. 2018).
Se presenta un caso clínico con el objetivo
de describir la evolución clínica de un paciente con fractura expuesta del
primer dedo del pie en el que se utilizó el lisado plaquetario. Para la
publicación de los detalles del caso se obtuvo el consentimiento del paciente,
lo que respeta las recomendaciones de la Declaración de Helsinki para las
investigaciones que se realizan en seres humanos.
PRESENTACIÓN DEL CASO
Se
presenta un paciente masculino de 42 años de edad, con antecedentes de sufrir
trauma en primer dedo del pie con arma blanca; el cual es recibido en el cuerpo
de guardia con herida mayor de 1cm en el dorso del primer dedo del pie derecho
que provocaba exposición de la articulación metatarso-falángica y pérdida de
sustancia ósea. La herida estaba acompañada de una moderada cantidad de cuerpos
extraños y los tejidos de la lesión se encontraban desvitalizados. El paciente
presentó dolor pero no sangramiento activo.
Se
realizaron exámenes complementarios y radiografía (Rx)de urgencia donde se
corroboró la solución de continuidad y pérdida ósea. Por los antecedentes, el
cuadro clínico y radiológico se realizó el diagnóstico de fractura expuesta
tipo II según la clasificación de Gustillo-Anderson (como se citó en Campbell,
James y Daniels, 2006).
Se
siguió el protocolo según la conducta a seguir para las fracturas expuestas,
donde al paciente se sometió a proceder quirúrgico para la realización de un
amplio Toilette y fijación intramedular con alambre de Kirschner. Al considerar
este tipo de fractura en gran manera infectadas o contaminadas, el paciente se
ingresó en sala convencional y se le indicó antimicrobianos como penicilina G
sódica, gentamicina y metronidazol además de cura local húmeda en días
alternos.
La
evolución del paciente no fue favorable debido a que presentó una infección
profunda localizada en el lugar de la lesión acompañada de secreción purulenta,
exposición ósea (Figura 1), dolor intenso, síntomas generales y fiebre
de hasta 39ºC, después de seis días de tratamiento y evolución tórpida se
decidió cambiar a cefalosporina de tercera generación (cefotaxima) sin mejoría
luego de 5 días de tratado.
.
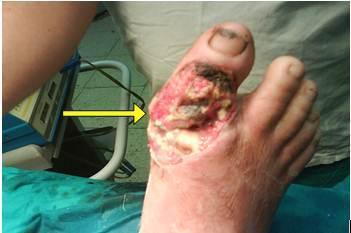
Figura
1.
Fractura expuesta del primer dedo del pie derecho
Dado
lo novedoso del uso de la medicina regenerativa y al no reportarse efectos
adversos al décimo día de tratamiento antimicrobiano, se comenzó la
infiltración profunda en días alternos del LP 1 ml en varios puntos de la
lesión, la cura convencional se complementó con la aplicación local de 2-4 ml
del lisado plaquetario en forma de cataplasma sobre la herida con la misma
frecuencia, manteniéndose la terapia antimicrobiana.
El
lisado se obtuvo de plaquetas autólogas, mediante donación realizada en el
banco de sangre.
La
producción del concentrado de plaquetas se realizó por los métodos establecidos
internacionalmente, el PRP se separó de la sangre entera por centrifugación
ligera y luego este se sometió a centrifugación rápida a mayores revoluciones
por minuto.
Todo
el procedimiento desde la recolección de la sangre entera, hasta la preparación
del concentrado, se realizó a temperatura de 20a 25ºC. Se evitó en todos los
casos el enfriamiento ya que puede producirse agregación plaquetaria y reducir
el rendimiento de la preparación. La separación se efectuó dentro de las seis a
ocho horas luego de la flebotomía. En el concentrado se dejó suficiente plasma,
entre 50 a 70 ml con la finalidad de mantener el PH > 6.
Luego
de obtenida la concentración de plaquetas se congelaron una hora y
posteriormente se descongelaron 6 minutos (de tres a seis veces) para obtener
un lisado homogéneo rico en factores de crecimiento para proceder a su
aplicación terapéutica (Yotsu, Hagiwara, Okochi, Tamaki, 2015).
Después
de 15 días del uso del LP el paciente comenzó a evolucionar de forma favorable
con disminución de la secreción por la herida, alivio del dolor, granulación de
partes blandas, que llegaba a cubrir las estructuras óseas expuestas y
desaparición de la fiebre (Figura 2).
.
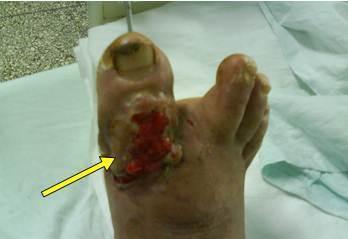
Figura
2.
Después de 15 días de tratamiento con lisado plaquetario
Debido
a la evolución clínica se dispuso a dar el alta hospitalaria a los 38 días del
ingreso del paciente y después de 21 días de tratamiento con LP (Figura 3).
Se
siguió el caso por consulta externa semanal por ocho frecuencias; luego
quincenal por 30 días y mensual por dos meses al terminar su rehabilitación.
El paciente se reincorporó a su actividad social habitual a los 6 meses de ser
tratado con el LP.

Figura 3.
Evolución favorable del paciente al alta médica
RESULTADOS
Y DISCUSIÓN
Los concentrados de plasma rico en plaquetas
(PRP) han sido utilizados en gran manera en la última década como complemento
en las técnicas de regeneración de tejidos. Los autores que han empleado en el
área clínica el LP aseguran que no existen riesgos de infección o transmisión
de enfermedades y niegan la existencia de algún tipo de efecto indeseable.
La utilización de fibrina liofilizada y de la
fibrina autóloga se ha utilizado desde hace décadas en los campos de la
traumatología, la cirugía bucal y maxilofacial, con el fin de compactar y
realizar una función osteoconductiva en los procedimientos de colocación de
injertos. En la década de los noventa, varios autores utilizaron los
concentrados a base de plasma rico en plaquetas (PRP) en injertos orales y
maxilofaciales, con el fin de obtener la fibrina de manera autóloga, activando
el PRP con trombina bovina. Observaron que, además del beneficioso efecto
osteoconductivo que aportaba la fibrina, existía un aporte de Factores de
Crecimiento beneficioso para la curación ósea. (Collazo
Álvarez, Collazo Marín, Boada, 2016)
Al inicio, los procedimientos de obtención de
PRP partían de cantidades de sangre muy grandes (500 cc) que requerían de una
aparatología especial y costosa que impedían la utilización en procedimientos
ambulatorios. Además, en estos sistemas y en algunos sistemas ambulatorios, se
utilizaba la trombina bovina para la activación que puede provocar rechazo
inmunitario y aparición de coagulopatías. Su utilización es controvertida, por
lo que no está difundido su uso (Plöderl, Strasser, Hennerbichler y
Peterbauer-Scherb, 2018).
Existen
publicaciones que exponen la utilidad por sus efectos cicatrizantes de este
procedimiento y se han obtenido resultados alentadores, que han aportado
evidencias científicamente válidas que acreditan la utilidad de su uso como
técnica terapéutica en la práctica médica. Aunque este tipo de estudio no
permite evaluar causalidad, en el caso que se reporta, el uso del LP parece
haber influido en la reparación adecuada del tejido afectado, secundario a una
fractura expuesta complicada, con una obtención accesible del producto y una
forma de aplicación sencilla, que logra una recuperación anatómica y funcional
de la región afectada y una incorporación del paciente a su actividad normal en
un tiempo corto.
CONCLUSIONES
Los
resultados alcanzados evidencian la efectividad del uso del lisado plaquetario
en el tratamiento de las lesiones graves producidas en los miembros inferiores,
como alternativa sencilla al tratamiento convencional. El uso de este
tratamiento es beneficioso, pues ante un caso con fractura expuesta y lesiones
infecciosas de partes blandas, la utilización del lisado plaquetario acelera el
proceso de cicatrización y granulación de tejidos, de esta manera facilita la
reincorporación del paciente a su vida social y laboral, al disminuir la
estadía hospitalaria por esta afección, además de reducir en gran medida el
riesgo de amputación y todo lo que esto conllevaría para el paciente y la
sociedad.
REFERENCIAS
BIBLIOGRÁFICAS
Campbell, W.C., James, W. H. y Daniels, A.
W.(2006). S. Terry Canale (Edit.)Cirugía Ortopédica: Fractura
Expuesta. Vol. 1.(10ma ed.) Memphis, Tennessee.
Carrillo Mora, P., González Villalva, A.,
Macías-Hernández, S., Pineda Villaseñor, C. (2018). Plasma rico en plaquetas.
Herramientas versátil de la medicina regenerativa. Cirugía, 81,
74-82. Recuperado dehttp://www.redalyc.org/articulo.oa?id=66225686011
Collazo Álvarez, H., Collazo
Marín, S., Boada, N. (2016). Factores de crecimiento plaquetarios en lesiones
traumáticas óseas y pseudotumorales. Rev Cubana HematolInmunolHemoter, 25(1)
Suppl. A1. Recuperado dehttp://scielo.sld.cu/pdf/hih/v29n3/hih13313.pdf
Hernández Ramírez, P. (2011). Medicina
Regenerativa y aplicaciones de las células madre: Una nueva revolución en
medicina.Revista Cubana de Medicina. 50(4),338-40. Recuperado de http://bvs.sld.cu/revistas/med/vol50_4_11/med01411.htm
Plöderl, K., Strasser, C.,
Hennerbichler, S., Peterbauer-Scherb, A. y Gabriel, C. (2018).Development and
validation of a production process of platelet lysate for autologous use. Platelets,22
(3), 204-209. Recuperado dehttp://www.ncbi.nlm.nih.gov/pubmed/21158495
Yotsu, R.R., Hagiwara, S., Okochi, H., Tamaki, T. (2015).
Case series of patients with chronic foot ulcers treated
with autologous platelet-rich plasma. JapaneseDermatologicalAssociation, 42 (3), 288–295. Recuperado de: http://onlinelibrary.wiley.com/doi/10.1111/1346-8138.12777/full