
ARTICULO DE INVESTIGACIÓN ORIGINAL
Fecha de presentación: 12-12-2020 Fecha de aceptación: 25-02-2021
Fecha de publicación: 3-03-2021
HEMORRAGIA
SUBARACNOIDEA ESPONTÁNEA Y SU EVOLUCIÓN EN EL HOSPITAL PROVINCIAL CAMILO
CIENFUEGOS DE SANCTI SPÍRITUS
SPONTANEOUS
SUBARACHNOID HEMORRHAGE AND ITS EVOLUTION IN THE CAMILO CIENFUEGOS PROVINCIAL
HOSPITAL IN SANCTI SPIRITUS
Dr.
Michel Sarduy-Gutiérrez1, Dr. Luis Alberto Núñez-Garriga 2,
Dra. Laura Luis García3
1 Especialista
Neurología. Profesor instructor. Hospital Provincial Sancti Spíritus, Cuba. michel.sarduy@nauta.cu.
ORCID ID: https://orcid.org/0000-0002-5767-0668. 2
Especialista en
Radiología e Imagenología. Profesor instructor. Hospital Provincial Sancti
Spíritus, Cuba. atgarriga@uniss.edu.cu.
ORCID ID: https://orcid.org/0000-0003-3963-6981. 3Especialista en MGI. Profesor Instructor.
Hospital Provincial Sancti Spíritus, Cuba. lauraluisgarcia93@gmail.com.
ORCID ID: https://orcid.org/0000-0002-8708-0677
_______________________________________________________________
¿Cómo citar este artículo?
Sarduy Gutiérrez, M. y Núñez
Garriga, L. A. (marzo-junio, 2021). Hemorragia subaracnoidea
espontánea y su evolución en el Hospital Provincial “Camilo Cienfuegos” de
Sancti Spíritus. Pedagogía y Sociedad, 24 (60), 280-304. Recuperado de http://revistas.uniss.edu.cu/index.php/pedagogia-y-sociedad/article/view/1195
_______________________________________________________________
RESUMEN
Introducción: La hemorragia subaracnoidea espontánea es de las enfermedades
neurológicas más temidas por su elevada mortalidad. Con el objetivo
general de describir el perfil clínico
evolutivo de los pacientes con hemorragia subaracnoidea espontánea en el
Hospital Provincial “Camilo Cienfuegos” de Sancti Spíritus, se realizó un
estudio observacional, descriptivo, prospectivo y longitudinal desde 2016 a
2019 en una población de 56 pacientes. Se asumieron como variables: edad, sexo,
color de la piel, factores de riego, evolución clínica, estadío clínico e imagenológico
al ingreso, estado al egreso y complicaciones. Se aplicaron los métodos
científicos del nivel teórico, empírico-experimental y matemático-estadístico.
La mayoría de los pacientes fueron del sexo femenino, entre 45 a 54 años de
edad, blancos y con el factor de riesgo fundamental de hipertensión arterial. Resultados: La evolución clínica según
estadía hospitalaria destacó el intervalo entre 7 a 14 días. Las principales
complicaciones aparecidas fueron: resangrado, vasoespasmo, complicaciones
respiratorias y tromboembolismo pulmonar. La mayoría de la población falleció a
su egreso hospitalario. Conclusiones: La investigación determinó una
asociación entre factores de riesgo y mortalidad en el perfil clínico evolutivo
de la hemorragia subaracnoidea espontánea.
Palabras clave: emergencias; factores de riesgo; hemorragias;
hemorragia subaracnoidea; mortalidad; neurología
Abstract: Spontaneous
subarachnoid hemorrhage is one of the most feared neurological diseases due to
its high mortality. Objective: To describe the clinical evolution
profile of patients with spontaneous subarachnoid hemorrhage at the Camilo
Cienfuegos Provincial Hospital in Sancti Spíritus. Therefore, an observational,
descriptive, prospective and longitudinal study was carried out from 2016 to
2019 in a population of 56 patients. The following variables were considered:
age, sex, skin color, risk factors, clinical evolution, clinical and imaging
stage at admission, state at discharge, and complications. Methodology:
Scientific methods from the theoretical, empirical-experimental and
mathematical-statistical levels were applied. Most of the patients were female,
between 45 and 54 years of age, white and with the major risk factor of
arterial hypertension. Results: The stage from day 7 to 14 was relevant
for the clinical evolution during the hospital stay. The main complications
that arouse were: re-bleeding, blood vessel spasm, breathing complications and
pulmonary thromboembolism. Most of the population died after being discharged.
The research determined an association between risk factors and mortality in
the clinical evolution profile of spontaneous subarachnoid hemorrhage.
Keywords:
emergency; risk factors; hemorrhage; subarachnoid hemorrhage; mortality;
neurology
INTRODUCCIÓN
a hemorragia subaracnoidea
(HSA) se produce cuando un vaso sanguíneo próximo a la superficie del cerebro
se rompe, y causa extravasación de sangre al espacio subaracnoideo (ES). Es el
cuarto trastorno vascular cerebral más frecuente después de la aterotrombosis,
la embolia y la hemorragia intracerebral primaria. El espacio subaracnoideo
forma parte de las meninges. El encéfalo y la médula espinal están cubiertos
por las capas meníngeas, que son una especie de membranas que protegen al
sistema nervioso central de golpes y agentes externos o internos nocivos y
sirven de sostén para importantes arterias y venas. Las meninges están formadas
por tres capas: duramadre, aracnoide y piamadre. Entre la aracnoide y la
piamadre se encuentra el ES. Por este espacio circula el líquido
cefalorraquídeo, además, se encuentran algunas arterias y venas cerebrales (Macdonald
& Schweizer, 2017).
Existen dos tipos de
hemorragias subaracnoideas: primaria y secundaria. La hemorragia subaracnoidea
primaria se da cuando la rotura del vaso sanguíneo se encuentra dentro del
espacio subaracnoideo, que provoca la invasión del espacio con sangre bajo una
presión bastante elevada (van Gijn, 2007). La secundaria se da cuando la sangre proviene de los
ventrículos o el parénquima. La hemorragia que se encuentra en el espacio
subaracnoideo accede rápidamente al sistema ventricular a través de la
circulación del líquido cefalorraquídeo. La cantidad máxima de sangre que
tolera el espacio subaracnoideo es de aproximadamente 100 ml; si la cantidad es
mayor puede provocar la muerte instantánea (Khoujah & Chang, 2017).
Las enfermedades
hemorrágicas constituyen el 20% del total de las enfermedades
cerebrovasculares, resultando la localización subaracnoidea la más frecuente
(por encima del 50%) (Kaptain, Lanzino Kassell, 2000).
Entre los factores de riesgo, además de
la edad, el sexo y la raza, se encuentran la hipertensión arterial (HTA) y el
consumo de tabaco y de alcohol. Un factor indispensable es el estrés
hemodinámico, que genera erosión y desgaste de la lámina elástica interna. Los
individuos con estados circulatorios hiperdinámicos están predispuestos a
sufrir cambios degenerativos acelerados en la pared del vaso con el subsecuente
desarrollo de aneurismas (Abraham, 2016).
La tasa de incidencia
anual (2017-2018) en Cuba fue de 88.1 por 100 000 habitantes para la enfermedad
cerebrovascular. Durante el año 2017 fallecieron 9 913 pacientes (Ministerio
de Salud Pública 2018). Dentro de este grupo, la HSA se distingue por ser una
causa mayor de mortalidad. Sin embargo, no se dispone de estudios
epidemiológicos que permitan conocer la frecuencia anual de esta afección, pero
se estima que deben ocurrir alrededor de 1100 casos (González Aguirre, 2012).
En Sancti Spíritus han sido muy escasos los estudios sobre esta entidad.
Las Unidades de Ictus (UI) elevan
considerablemente la calidad de la atención médica y paramédica en estos
enfermos. Sancti Spíritus consta con una sala de este tipo desde 1999. El
diagnóstico correcto, primero del tipo de Enfermedad Cerebrovascular (ECV) y
luego del subtipo de Ictus, también es imprescindible, aspecto revolucionado
con el uso de la Tomografía Axial Computarizada (TAC), “complementario de oro”
en esta entidad clínica. Se plantea como situación problémica que la ECV
constituyen la tercera causa de muerte y primera en discapacidad, tanto a nivel
mundial como en Cuba y en la provincia de Sancti Spíritus, con una alta
letalidad en el Hospital General Provincial “Camilo Cienfuegos” durante los
últimos años. A la hemorragia subaracnoidea le corresponde alrededor del 10% de
los pacientes: ha fallecido un 5% y de los sobrevivientes, casi la mitad queda
discapacitada.
En el presente trabajo se pretende
abordar cómo influyen los factores de riesgo en el pronóstico de pacientes con
diagnóstico de hemorragia subaracnoidea espontánea en el Hospital General
Provincial “Camilo Cienfuegos” de Sancti Spíritus en el periodo 2016-2019 según
el perfil clínico evolutivo:
La aparición de HSAE tiene picos entre
los 50 y los 60 años de edad. “La condición es de 1.6 veces más común en
mujeres que en hombres, pero esta diferencia se hace evidente solo después de
la quinta década” (Gritti, 2018, p. 208). El estrógeno
y, menos frecuentemente, la progesterona, se han postulado tener efectos
protectores y contribuir así al aumento de la incidencia en mujeres
posmenopáusicas. Sin embargo, un metaanálisis mostró que estas hormonas podrían
afectar el riesgo de hemorragia subaracnoidea pero los datos fueron confluentes
y no hubo conclusiones consistentes (de Rooij y Linn, 2007).
Los estudios de factores de riesgo
tienen algunos resultados que podrían estar relacionados con sesgo en los
estudios y apuntan a una comprensión incompleta de los aneurismas. Factores de
riesgo modificables son fumar, hipertensión y exceso de ingesta de alcohol, que
casi duplica el riesgo individualmente, mientras que un efecto protector más
débil es asociado con el ejercicio regular y el aumento de colesterol.
Por lo anterior expuesto este artículo
se propone describir el perfil clínico evolutivo de los pacientes con
diagnóstico de hemorragia subaracnoidea espontánea en el Hospital General
Provincial “Camilo Cienfuegos” de Sancti Spíritus.
MARCO TEÓRICO O REFERENTES CONCEPTUALES
Esta enfermedad fue un misterio hasta el
siglo XIX. Las primeras descripciones de un aneurisma arterial datan de 3000
años antes de Cristo. Se cree que Imhotep (2725 a.n.e), el fundador de la medicina egipcia antigua, es el autor de un párrafo que se encuentra
en el papiro de Ebers sobre el tratamiento de los aneurismas arteriales
utilizando cauterio.
El progreso de la
comprensión de los aneurismas arteriales como causa de hemorragia subaracnoidea
fue prácticamente inexistente durante muchos años debido a las supersticiones
religiosas y la dependencia del examen corporal externo. No fue hasta dos
milenios después cuando se registraron los primeros mecanismos fisiopatológicos
(Milinis, Thapar, O’Neill & Huw Davies A.,
2017).
El
médico de Éfeso Flaenius Rufus (117 a.n.e.), quien se formó en Alejandría,
sugirió que la dilatación arterial podría ocurrir como resultado de un trauma.
Varios cientos de años más tarde, el médico griego Galeno de Pérgamo (129-210 d.n.e)
acuñó el término aneurisma (aneurisma griego, una ampliación; desde anu,
'a través de', y eurys, 'amplio') y reconoció dos entidades distintas de
aneurismas arteriales verdaderos y falsos.
La ligadura arterial periférica fue
popularizada por John Hunter (AD 1728–1793), el primero en realizar la ligadura
del cuello proximal de un aneurisma poplíteo.
La primera descripción del tratamiento
de un aneurisma intracraneal fue documentada por Victor Horsley (1857-1916) en
1885, quien descubrió por casualidad un aneurisma masivo en la fosa craneal
media mientras operaba a un paciente con sospecha de tumor cerebral. Horsley
realizó con éxito la ligadura de una arteria carótida cervical y, según el
último informe de Keen, el paciente se encontraba bien de salud cinco años
después.
En 1911, Cushing diseñó un clip de plata
para controlar los vasos sanguíneos profundos e inaccesibles durante la
resección del tumor cerebral. A pesar de haber inventado el clip, Cushing nunca
lo usó para asegurar aneurismas cerebrales; en cambio, fue su competidor Walter
Dandy (1886–1946), quien realizó con éxito el primer recorte de un aneurisma
intracraneal en 1937 utilizando el clip de Cushing después de que McKenzie
realizó pequeñas modificaciones. En los años siguientes, la práctica de
recortes de aneurismas se extendió por todo el mundo a medida que la noción de
tratamiento de la hemorragia subaracnoidea pasó de tener rodamientos quirúrgicos
remotos a una condición en gran medida curable. Sin embargo, la cirugía
intracraneal no estuvo exenta de riesgos. Debido a los instrumentos subóptimos,
la falta de magnificación y la neuroanestesia primitiva, muchos cirujanos
continuaron practicando el reposo en cama o la ligadura de la carótida hasta
los años setenta. Durante este tiempo, se hicieron importantes avances para
hacer que los clips fueran extraíbles, más fáciles de ajustar y más seguros de
implementar.
La introducción del microscopio
operatorio por Kenichiro Sugita (1932–1994), quien también desarrolló un clip
de aneurisma ampliamente utilizado, abrió nuevas oportunidades para acceder a
partes del cráneo que antes se creía inconcebible.
Theodore Kurze (1923–2002) fue el primer
neurocirujano en utilizar un microscopio quirúrgico para cortar un aneurisma en
1957. El microscopio y la craneotomía bifrontal para exponer el aneurisma
fueron parte de la amplia experiencia de Pool. Finalmente, en 1969, los
resultados del estudio cooperativo de Aneurisma Intracraneal y Hemorragia
Subaracnoidea mostraron una reducción significativa de la mortalidad con el
recorte sobre el manejo conservador y la ligadura de la carótida, lo que
proporcionó una justificación para la intervención intracraneal.
La hemorragia subaracnoidea
espontánea es una emergencia neurológica caracterizada por la extravasación de
sangre al espacio subaracnoideo no causada por traumatismo. Comúnmente produce
un daño permanente al Sistema Nervioso Central (SNC), a consecuencia de ello se
desarrollan rápidamente signos de disfunción neurológica y/o cefalea intensa.
En ocasiones, estos síntomas no tienen una estrecha relación con la gravedad o
intensidad del evento, por lo que es reconocida dentro del grupo de las
catástrofes neurológicas.
La incidencia de HSAE en estudios de
base poblacional, incluso fuera del hospital, es de 9.1 casos por cada 100 000
personas por año (IC 95% 8.8-9.5), con algunas variaciones regionales.
Finlandia (19.7 casos por 100 000 personas por año, 18.1-21.3) y Japón (22.7
casos por 100 000 personas por año, 21.9-23.5) tienen las incidencias más altas
reportadas. Existe controversia en cuanto a si estas variaciones en la
incidencia son reales o son debido a las diferencias en la investigación del
caso. La incidencia de HSAE está cayendo, de 0 a 6% por año de 1955 a 2003.
Aproximadamente el 85% de los eventos espontáneos, son aneurismáticos y el 10%
son perimesencefálicos no aneurismáticos. El 5% restante tiene causas diversas.
La hemorragia subaracnoidea perimesencefálica no aneurismática tiene un patrón
específico en la TC inicial y tiene un resultado más favorable que el que tiene
el típico subtipo aneurismal (Macdonald,
y Schweizer, 2017 y De Rooij, Linn, van der Plas, Algra A, Rinkel, 2007).
Los aneurismas cerebrales saculares son
lesiones adquiridas que se desarrollan en los puntos de ramificación de las
principales arterias del círculo de Willis. Se desarrollan en respuesta a la
hemodinámica por degeneración inducida por estrés de la lámina elástica interna
con adelgazamiento secundario y pérdida de la túnica media. Se han observado
múltiples mecanismos fisiopatológicos propuesto. El tamaño medio de la ruptura
de un aneurisma es de 6 a 7 mm (Macdonald, Schweizer, 2017 y Macdonald, 2014).
La hemorragia subaracnoidea aneurismática
inyecta sangre en el espacio subaracnoideo en casi todos los casos. El sangrado
en los ventrículos y el cerebro mismo son comunes, pero las hemorragias en el
espacio subdural son infrecuentes (<5%). Esto es importante en el
diagnóstico de un aneurisma roto, en el sentido de que un hematoma subdural
agudo por sí mismo es poco probable para ser causado por un aneurisma roto (Ídem).
Se produce lesión cerebral por
hemorragia subaracnoidea en dos fases. Hay una lesión cerebral temprana que es
demostrado por el grado neurológico del paciente, que es causada por la
isquemia global transitoria y los efectos tóxicos de sangre subaracnoidea. La
destrucción directa del tejido cerebral por una hemorragia intracerebral es
otro factor. La hemorragia subaracnoidea es única en que hay una fase retardada
de lesión cerebral en la que se retrasa el deterioro neurológico por retraso
cerebral. La isquemia se desarrolla en un tercio de los pacientes 3 a 14 días
después de la hemorragia (Macdonald,
Schweizer T, 2017 y Fujii, Yan,
Rolland, Soejima, Caner y Zhang, 2013).
Existe una respuesta sistémica en la
hemorragia subaracnoidea que puede afectar los pulmones (edema pulmonar,
síndrome de dificultad respiratoria aguda), corazón (arritmias, anomalías de la
contractilidad), y fluidos y balance electrolítico, y puede causar síndrome de
respuesta inflamatoria sistémica. Mecanismos comunes para esta respuesta
sistémica es un aumento de la actividad del sistema nervioso simpático, con
aumento de catecolaminas, péptido natriurético, activación del sistema de
renina-angiotensina y citoquinas inflamatorias.
La clasificación de la HSA
es imprescindible que se realice en las primeras horas tras la aparición del
sangrado, puesto que es lo que marcará la forma de actuación y el tratamiento
posterior de la patología. Para ello, existen escalas validadas
científicamente, cuya función será de gran ayuda para el pronóstico y la
posterior evolución del paciente, además de permitir conocer más a fondo la
situación en la que se encuentra, para poder dar una información más exacta de
su estado a él mismo o a su familia (Vivancos, Gilo,
Frutos, Maestre, García Pastor y Quintana et al, 2014; Rebanal Poo , 2017; Suárez, Tarr y Selman , 2006; y Cappelen Smith, Calic y Cordato, 2017).
La HSAE se trata de una
urgencia neuroquirúrgica realmente difícil de diagnosticar, por lo que se debe
sospechar directamente si el paciente presenta o ha presentado anteriormente
cefaleas bruscas y persistentes de gran intensidad (Rebanal Poo, 2017 y Alonso,
Rodero y Ros Tristán, 2008).
Como se ha mencionado
anteriormente, la prueba diagnóstica de elección es la TAC craneal, puesto que
tiene un 100% de fiabilidad si se realiza durante los cinco primeros días tras
la aparición de los síntomas. La TAC se realizará con el objetivo de descartar
una HSA. El paciente suele presentar uno o varios de los siguientes síntomas (Rebanal
Poo E., 2017):
§
Cefalea de inicio brusco y
explosivo.
- Cefalea persistente de
gran intensidad.
- Cefalea que aumenta en
relación con el esfuerzo físico realizado.
- Cefalea con focalidad
neurológica asociada.
- Cefalea acompañada de
rigidez nucal.
- Cefalea con presencia
de vómitos y acompañada de migrañas.
- Pérdida de
conciencia asociada o no a cefalea acompañada de rigidez de nuca con sospecha
de HSA.
Una vez realizada la prueba,
si el resultado es negativo pero la sospecha clínica es elevada, se deberá
realizar una punción lumbar pasadas unas horas de la TAC. Si al llevar a cabo
dicha punción lumbar (PL) se obtiene una muestra de líquido cefalorraquídeo
(LCR) cuyo contenido presenta hematíes y xantocromía, siendo lo habitual un
líquido transparente de consistencia acuosa, se confirmará el diagnóstico. En
estos casos es realmente importante tener en cuenta la exactitud a la hora de
realizar dicho procedimiento, puesto que una PL traumática podría darnos lugar
a error en el diagnóstico, por lo que será imprescindible el posterior
centrifugado del líquido. Cabe también decir que la PL temprana (sangrado desde
hace 12 horas o menos) puede darnos resultados negativos y por otro lado,
pasadas ya tres semanas desde el inicio del sangrado, el LCR también podrá
normalizarse (Macdonald, Schweizer, 2017;
Rebanal
Poo, 2017; Vivancos, Gilo, Frutos, Maestre, García Pastor,
Quintana, et al., 2014; Alonso, Rodero, Ros Tristán,
2008 y Becker, Greiner, Kaune, Winkler, Brawanski, Warmuth Metz et al., 1991).
Si finalmente se diagnostica
HSA mediante una de las dos pruebas anteriores, se deberá completar el estudio
mediante una prueba que nos muestre donde se encuentra el foco de la hemorragia.
Este estudio se realizará mediante una angio-TAC o una angio-resonancia magnética
(angio-RM) (Ídem).
Si se obtiene un resultado
positivo en la angio-TAC, es decir, si hay presencia de lesión por aneurisma,
se deberá programar un cateterismo urgente para confirmar las características
del aneurisma y así poder tomar una decisión terapéutica definitiva lo antes
posible. El cateterismo a realizar será una arteriografía cerebral diagnóstica
en el plazo de las 5 horas.
Si por el contrario el
resultado del estudio angiográfico resulta negativo, se recomienda repetir el
procedimiento una vez más pasado un mínimo de dos semanas, para descartar
definitivamente la posibilidad de sangrado) (Ídem).
En primer lugar, tras
confirmarse un diagnóstico de HSA en un paciente, se comunicará el caso
inmediatamente a los servicios de Medicina Intensiva y/o Neurocirugía.
Una vez diagnosticada
definitivamente la HSA y preferentemente previo al ingreso hospitalario, se
deberán realizar una serie de pruebas complementarias necesarias para un
posterior tratamiento de la patología (Greving, Wermer, Brown,
Morita,
Juvela,
Yonekura,
et al., 2014):
- Hemograma.
- Estudio de coagulación.
- Estudio de bioquímica,
en el que se deben incluir los niveles de troponina.
- Gasometría arterial o
venosa
- Pruebas cruzadas.
- Electrocardiograma de
12 derivaciones.
- Radiografía
torácica.
METODOLOGÍA EMPLEADA
Se realizó un estudio observacional,
descriptivo, prospectivo y longitudinal en el Hospital
General Provincial “Camilo Cienfuegos” de Sancti Spíritus desde enero
2016 a enero 2019.
La población incluyó 56 pacientes
ingresados en el Hospital General “Camilo Cienfuegos”
de Sancti Spíritus en el período mencionado con el diagnóstico de hemorragia subaracnoidea.
Métodos científicos:
Del nivel teórico:
Analítico-sintético: Posibilitó analizar
la situación actual del problema planteado para seleccionar aspectos y
relacionados con esa selección incluir los que debían estar en el trabajo investigativo.
Histórico-lógico: Al abordar la
información que existe sobre el problema
Inductivo-deductivo: Se utilizó en el
diseño investigativo y para la elaboración de las conclusiones y
recomendaciones.
Método de enfoque sistémico: Este
enfoque estuvo a lo largo de la investigación, y su esencia fundamental fue la
relación lógica y armónica de todos los elementos considerados en el desarrollo
de la investigación.
Del nivel empírico-experimental:
Revisión documental: Se revisó el
registro estadístico del Hospital General “Camilo
Cienfuegos” de Sancti Spíritus para la determinación de la cantidad de
pacientes con el diagnóstico de hemorragia subaracnoidea espontánea desde enero 2016 a enero 2019.
Modelo de recolección de datos: Creado y
previamente validado en la investigación: “Factores pronósticos
de la evolución en la hemorragia cerebral espontánea” de Misis del Campo MT (Varona Miyares I, 2016).
Del nivel matemático-estadístico:
Para el análisis de la información y
aplicación de las pruebas estadísticas, esta fue introducida en una base de
datos, siendo automatizada y procesada mediante el sistema SPSS (Stadistical,
Package, Scientific, Social) versión 19.0 por Windows XP, lo cual se presentó
en tablas de distribución de frecuencias absolutas y relativas. La posible
relación entre factores de riesgo y mortalidad en el perfil clínico evolutivo
de la hemorragia subaracnoidea espontánea, se calculó mediante el riesgo
relativo (RR) por la fórmula:

RESULTADOS Y DISCUSIÓN
La descripción del perfil clínico
evolutivo de la hemorragia subaracnoidea espontánea en el
Hospital General Provincial “Camilo Cienfuegos” de Sancti Spíritus desde enero
2016 a enero 2019 permitió arribar a los siguientes
resultados:
Según el registro estadístico del Hospital General Provincial Camilo Cienfuegos de Sancti
Spíritus, la determinación de la cantidad de pacientes con el diagnóstico de
hemorragia subaracnoidea espontánea (tabla 1 y gráfico 1) mostró un
descenso partiendo en el año 2016 de un 37.5%, luego un 34% en el 2017 y un
28.5% para el 2018. El autor justifica esta situación
al mejor control de los factores de riesgo vascular en el ámbito de la atención
primaria que repercute de manera favorable en la tasa de incidencia de esta
entidad (Vivancos, Gilo, Frutos y Maestre, 2014). Sin embargo, el estudio European Registers of Stroke (EROS)
refiere que el descenso en la ECV no repercute de la misma manera en la HSA
cuya incidencia permanece invariable en 9 casos/100.000 habitantes-año (Heuschmann,
2009).
En la mayoría de las
poblaciones. la incidencia de la HSA se mantiene estable en aproximadamente 10
por 100 000 habitantes/año (rango entre 2 y 20 según la población estudiada)
brindando un estimado cercano a los 1100 casos de HSA por cada año en Cuba.
La distribución de la población según
edad en esta investigación arrojó que en el intervalo de 45-54 años se encontró
la mayoría de los casos con diagnóstico de HSAE (16 pacientes y un 28.57%),
cercano a este dato se observó en un 21.43% la población entre 35-44 años y
55-64 años, respectivamente.
Todos los referentes
teóricos señalan que la incidencia de la HSAE aumenta con la edad, ocurriendo
la mayor parte de los casos entre los 40-60 años (presentación media a partir
de los 50 años) (Hall y O'Kane R, 2018), fundamentación que ampara científicamente los resultados
encontrados con esta variable.
La Sociedad Española de
Neurocirugía (SENEC) constató un incremento en la incidencia a partir de los 50
años (Gritti, Akeju, 2018). Otros investigadores
señalan edades más frecuentes por encima de este rango: Varona Miyares
(2016), Jiménez Leal (2017), Millán Cordoví (2014), Coaquira
Jara (2015), Cánovas Vergé (2007), Ingelmo
Cereceda (2015), Palacios Gómez (2018) y Linares Cristobal (2018).
Los hallazgos del presente
estudio tienen similitud con los encontrados por los autores: Gascón Castillo (2017), Scherle Matamoros (2007),
Argüeso García (2015), Pérez Nellar (2014) y Bastos Silva Aguiar Coelho (2016).
La presencia de hemorragia subaracnoidea
espontánea según sexo demostró que las mujeres fueron más propensas a presentar
esta entidad en el 85.7% de los casos (48) y solo el 14.3% (8 pacientes)
perteneció a los hombres. La incidencia claramente
superior de HSAE en el sexo femenino es una aseveración que se repite en
diferentes textos fundamentados en los resultados de diversos estudios, no
obstantes, otras publicaciones lo cuestionan.
Los factores de riesgo relacionados en
el grupo estudiado (tabla 1) presentaron en orden de frecuencia a: hipertensión
arterial, hábito de fumar y alcoholismo. El
predominio de la HTA corrobora que, para la afección investigada, es el
principal factor vinculado a la posibilidad de padecer de una HSAE. Es una
evidencia científica que los principales factores de riesgo modificables siguen
siendo la HTA, que duplica el riesgo para la presión arterial sistólica >
130 mm Hg y lo triplica para un valor > 170 mm Hg, el tabaco y el alcohol (Vivancos,
2014).
Tabla 1.
Distribución de la población según factores de riesgo. Hospital General
Provincial Camilo Cienfuegos Sancti Spíritus 2016-2019.
La evolución clínica de los pacientes
con HSAE (tabla 2) según tiempo de estadía hospitalaria estuvo de forma
prioritaria entre 7 a 14 días (55.36%), seguido del intervalo 15 a 20 días (26.79%)
y 3 a 6 días (10.71 %). Según el autor,
este resultado estuvo justificado por la aparición de complicaciones que
obstaculizaron la recuperación entre los primeros 6 días.
Tabla 2.
Identificación de la evolución clínica según tiempo de estadía hospitalaria.
Hospital General Provincial “Camilo Cienfuegos” Sancti Spíritus 2016-2019
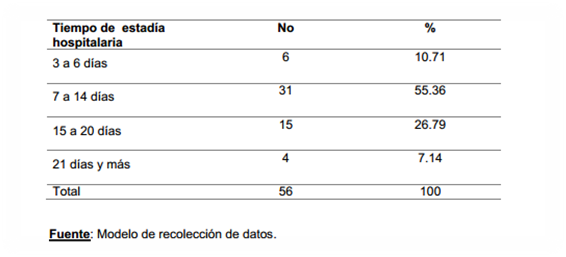
Los
tiempos de estadía hospitalaria identificados son similares a los reportados
por Varona Miyares I(2016), 8 a 14 días y Misis
del Campo (2014), 8 días.
Algo distante de los 19 días encontrados por Argüeso García (2015).
La escala de Hunt y Hess se
trata de una de las escalas neurológicas de clasificación basada en la gravedad
de una HSA no traumática cuya función principal es ayudar a la anticipación del
pronóstico del paciente. Esta escala está basada en la situación clínica en la
que se encuentra el paciente en relación con 5 niveles de síntomas perceptibles
y que se hayan directamente relacionados con el riesgo de muerte, de tal manera
que el riesgo de mortalidad será mínimo para aquellos que obtengan un primer
grado y máximo para aquellos que obtengan un quinto grado (Suárez, Tarr,
Selman, 2006).
Tabla 3. Escala de Hunt y Hess
|
Grado
|
Características clínicas
|
|
Grado I
|
Paciente asintomático o
con leve cefalea y ligera rigidez de la nuca.
|
|
Grado II
|
Paciente con dolor de cabeza de moderado a
severo, rigidez de la nuca, sin déficit neurológico fuera de la parálisis de
los nervios craneales
|
|
Grado III
|
Paciente somnoliento o
confuso, débil o con un déficit neurológico focal leve.
|
|
Grado IV
|
Paciente muy aturdido con hemiparesia
(parálisis o inmovilidad en una mitad del cuerpo).
|
|
Grado V
|
Paciente comatoso con
postura de descerebración.
|
La escala de Fisher
relaciona directamente el grado en el que se encuentra el paciente con el
riesgo de vasoespasmo, así pues, los grados I y II que bien, o no presenta
sangre en la TC craneal (grado I) o presenta sangre difusa pero no lo
suficiente como para formar coágulos (grado II), no se predice riesgo de
vasoespasmo. Sin embargo, la escala modificada de Fisher no diferencia si se
trata de una HSA focal o difusa, pero sí que tiene en cuenta en todo momento el
riesgo sumatorio y aditivo de presentar sangre en el espacio interventricular y
subaracnoideo y la puntuación será del 0 al 4. Cuanto mayor sea la puntuación
obtenida, mayor será el riesgo de isquemia cerebral tardía por vasoespasmo
(Cappelen-Smith, Calic, Cordato, 2017).
Tabla 3. Escala de Fisher
|
Grado
|
Características radiológicas
|
|
Grado I
|
No se detecta sangre en la TAC craneal
|
|
Grado II
|
Capas difusas o verticales menores de 1 mm de grosor
|
|
Grado III
|
Coágulo localizado y/o capa vertical mayor de 1 mm de grosor
|
|
Grado IV
|
Coágulo intracerebral o intraventricular con HSA difusa
|
El
estadío al ingreso se evaluó clínicamente mediante la escala de Hunt-Hess e
imagenológicamante por la escala de Fisher. La población al ingreso presentó
principalmente un estadío II según la escala de Hunt-Hess con un 39.29%,
seguido en un 26.79% por el estadío III y un 21.43% en el estadío I. La
evaluación al ingreso según escala de Fisher destacó el 42.86% en el estadío
III, luego el 28.57% en el II y alejadamente el 17.86% del IV.
Las
evaluaciones clínicas al ingreso expuestas en esta investigación se relacionan
directamente con las observadas para el
estadío II por: Gascón Castillo (2017) con
un 55.7%, Argüeso García (2015) con un 46.2% y Bastos Silva Aguiar
Coelho (2016) con un 39%. Las evaluaciones imagenológicas al ingreso fueron
similares con las de Argüeso García (2015) con 40.3% y las
de Pérez Nellar J (2014) con 46.6%, pero diferentes
a los resultados de Gascón Castillo (2017) con
47.5% para el estadío IV, de Scherle Matamoros (2016) con 41.4% para el
estadío III y Bastos Silva Aguiar Coelho
(2016) con 27% para el estadío IV.
Los factores de riesgo de
resangrado son: la demora en el ingreso y en el inicio de tratamiento; la PAS
>160 mm Hg (aunque está más relacionado con cambios en la presión sanguínea,
que con una cifra determinada), y la mala situación neurológica al ingreso (Nieuwkamp,
Rinkel, Silva, Greebe, Schokking, Ferro, 2006).
Otra de las complicaciones
neurológicas presente en este estudio fue el vasospasmo cerebral sintomático.
Esta complicación aparece por lo general entre los días 4 y 12, habiéndose dado
casos de vasospasmo hasta varias semanas después del sangrado inicial o de
inicio más precoz a partir de las primeas 48 h. La presencia de vasospasmo
angiográfico se da hasta en el 66% de los pacientes, pero el vasospasmo
sintomático (isquemia cerebral tardía) ronda tan solo el 30%. Su intensidad
guarda una relación directa con la cantidad de sangre extravasada inicial.
(Huilca Flores, Betancourt Nápoles, 2016 y Scherle Matamoros, Pérez Néllar,
Roselló Silva, Cutiño Maas, Amaro Hernández y Matos, 2007).
En un estudio realizado en
La Habana, Cuba; Scherle Matamoros y su equipo (Scherle
Matamoros, Pérez Néllar, Roselló Silva, Cutiño Maas, Amaro Hernández, Matos,
2007), reportaron una alta mortalidad en pacientes
con vasospamo sintomático (42%) posterior al sangrado subaracnoideo siendo las
alteraciones cognitivas y del comportamiento las manifestaciones más comunes.
Otros autores (Nieuwkamp, Rinkel, Silva, Greebe, Schokking, Ferro,
2006); reportan que de todos los pacientes con HASE, un 22%
presentó vasospasmo sintomático con un OR de 1,6 (IC 95%: 0,5-4,8).
La clasificación de la población según
estado al egreso (tabla 10 y gráfico 10) destacó el fallecimiento en un 78.57%
y solo el restante 21.43% sobrevivió a la HSAE.
En cuanto a las condiciones
de egreso de los pacientes, los resultados reflejan la magnitud del problema
que se investiga. Como bien se refirió previamente, en estudios anteriores las
estadísticas son alarmantes, la mitad de los pacientes fallecen y la otra mitad
egresan con alguna secuela. En esta investigación los resultados no son tan
lejanos de esa realidad.
La ECV mantiene un patrón
con tendencia al alza constante en cuanto a la mortalidad. Un análisis de los
últimos 25 años sobre la Enfermedad Cerebrovascular en el Ecuador publicado en
el 2016 por la Revista Ecuatoriana de Neurología concluyó que del número
total de muertes (1 222. 173 muertes), la ECV representó 77 897 muertes
(6,70%). Al revisar los hallazgos tomográficos, se puede observar que los ECV
hemorrágicos fueron en su mayoría positivos (63.88%) en las primeras 24 horas
(Palacios Gómez, 2018).
Varona Miyares (2016) señala que
fallecieron más del 50% de los pacientes con hemorragia subaracnoidea
espontánea, siendo el edema cerebral severo la principal causa de muerte.
Esta afirmación no fue constatada en
esta investigación ya que los principales artículos, que estudian la
correlación de dichas escalas, recalcan que ninguna de las escalas alcanza una
correlación sumamente fuerte o perfecta con el pronóstico funcional, lo que
podría deberse a que el pronóstico en esta patología tiene una naturaleza
multifactorial, incluyendo tanto antecedentes como factores desarrollados al
ingreso y durante la estancia hospitalaria (Palacios Mendoza, 2014).
A
pesar de la tendencia decreciente en las cifras de mortalidad observada en los
últimos 20 años, relacionada tanto con la detección y el control de los
principales factores de riesgo como con los muy importantes avances en el
diagnóstico y el tratamiento de la HSA, el impacto de esta afección continuará
incrementándose en los próximos años, pues la Organización Mundial de la Salud
predice un incremento de un 27% en su incidencia entre 2000 y 2025 (Meurer,
2016).
La determinación de la posible relación
entre factores de riesgo y mortalidad en el perfil clínico evolutivo de la
hemorragia subaracnoidea espontánea arrojó el RR siguiente:

Su interpretación práctica significa que
el paciente que posea factores de riesgo asociados a la HSAE es probable que
aproximadamente 13,6 veces tenga probabilidad de fallecer, que si no tenga
dichos factores según los resultados aportados por la presente investigación.
El
desarrollo de planes de atención al paciente con HSAE que permitan el acceso
rápido a una atención neurológica especializada en una Unidad
de Ictus,
la disponibilidad de tratamientos eficaces y el mejor conocimiento de los
factores asociados a un mayor riesgo de mortalidad deben contribuir a disminuir
la importante carga sociosanitaria.
Dentro de las limitaciones
que tiene este trabajo se hallaron las propias que se derivan del diseño
(observacional), además de que el pronóstico tiene una relación multicausal,
que indiscutiblemente no solo agrupa las variables que se abordaron.
CONCLUSIONES
La determinación de la
cantidad de pacientes con el diagnóstico de hemorragia subaracnoidea espontánea
mostró
un descenso partiendo del año 2016 al 2018 debido al
mejor control de los factores de riesgo vascular en el ámbito de la atención
primaria.
Los pacientes diagnosticados con hemorragia subaracnoidea espontánea en esta
investigación se presentaron principalmente en el sexo femenino, entre 45 a 54
años de edad, de color blanco y con el factor de riesgo fundamental de
hipertensión arterial debido a la relación directamente proporcional entre la edad, sexo y los factores de riesgo con la incidencia
de esta entidad.
La evolución clínica de los pacientes
con hemorragia subaracnoidea espontánea según
estadía hospitalaria destacó el intervalo entre 7 a 14 días justificado por la
aparición de complicaciones que obstaculizaron la recuperación entre los
primeros 6 días.
La población estudiada
presentó mayoritariamente al ingreso un estadío clínico II según la escala
HUNT-HESS y un estadío imagenológico III según la escala FISHER.
Las principales complicaciones
aparecidas fueron en orden de frecuencia: Resangrado, Vasoespasmo,
Complicaciones respiratorias y Tromboembolismo pulmonar.
La mayoría de la población con hemorragia subaracnoidea espontánea falleció a su
egreso hospitalario lo que podría deberse a que el pronóstico en esta patología
tiene una naturaleza multifactorial.
La investigación determinó una
asociación entre factores de riesgo y mortalidad en el perfil clínico evolutivo
de la hemorragia subaracnoidea espontánea.
REFERENCIAS BIBLIOGRÁFICAS
Abraham, M.K.
& Chang, W. W. (Nov.,
2016). Subarachnoid Hemorrhage. Emergency Medicine Clinics of North America,
34(4), 901-916. Recuperado de https://doi:10.1016/j.emc.2016.06.011
Alonso, E.,
Rodero, F. y Ros Tristán C. (2008). Diagnóstico de la hemorragia subaracnoidea
espontánea de escasa cuantía o de larga evolución: a propósito de un caso. Medicina
Interna, 25(7), 212-719. Recuperado de http://scielo.isciii.es/pdf/ami/v25n7/nota2.pdf
Argüeso García M. (2015). Pronóstico
de la hemorragia subaracnoidea espontánea aneurismática y su correlación con
escalas de gravedad, escalas de calidad de vida y tratamiento endovascular (Tesis
doctoral). Universidad de Valencia. Valencia, España. Recuperado de http://roderic.uv.es/bitstream/handle/10550/50503/TESIS%20DOCTORAL%20MONICA%20ARGUESO%20GARCIA.pdf?sequence=2&isAllowed=y
Bastos Silva Aguiar Coelho, L. G., Dias Costa J. M., Peixoto
Azevedo, Silva EI. (2016). Hemorragia subaracnóidea espontânea não
aneurismática: perimesencefálica versus não perimesencefálica. Revista Brasileira
de Terapia Intensiva, 28(2),141-146. Recuperado de https://doi:10.5935/0103-507X.20160028
Becker, G., Greiner, K., Kaune, B.,
Winkler, J., Brawanski, A., Warmuth Metz, M. et al. (1991). Diagnosis and monitoring of subarachnoid hemorrhage by transcranial
color-coded real-time sonography. Neurosurgery; 28(6), 814-820. Recuperado de https://doi.org/10.1097/00006123-199106000-00005
Bederson, J., Connolly, E.,
Batjer, H., Dacey, R., Dion, J., Diringer, M. et al (2009). Guidelines for the management of aneurysmal subarachnoid
hemorrhage: a statement for healthcare professionals from a special writing
group of the Stroke Council, (AHAS) American Heart Association. Stroke, 40(3), 994-1025. https://doi.org/10.1161/STROKEAHA.108.191395
Cánovas Vergé, D. (2007). Etiología y factores pronósticos de la hemorragia subaracnoidea no aneurismática (Tesis propuesta para la obtención
del grado de Doctor en Medicina y Cirugía) Universidad de Barcelona. Barcelona,
España. Recuperado de https://dialnet.unirioja.es/servlet/tesis?codigo=77990
Cappelen Smith,
C., Calic, Z. & Cordato, D. (2017). Reversible cerebral vasoconstriction
síndrome: recognition and treatment. Current Treatment Options in Neurology
Journal, 19(6),460-467. Recuperado de https://doi.org/10.1007/s11940-017-0460-7
Coaquira Jara, J.
M. (2015). Indicadores predictivos de
mortalidad en pacientes con hemorragia subaracnoidea primaria atendidos en el
Hospital PNP “Luis N. Sáenz” (2009-2013) (Tesis para optar el Título de Especialista en Medicina Intensiva).
Universidad de San Martin de Porres, Lima, Perú.
De
Rooij, N.K., Linn, F.H., van der Plas, J.A., Algra, A. & Rinkel, G.J.
(2007). Incidence
of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender
and time trends. Neurology,
Neurosurgery and Psychiatry Journal;
78(12), 1365-1372. Recuperado de https://doi.org/10.1136/jnnp.2007.117655
Fujii, M., Yan, J.,
Rolland, W.B., Soejima, Y., Caner, B. & Zhang JH. (2013). Early brain injury, an evolving frontier in subarachnoid
hemorrhage research. Translational Stroke
Research, 4(4), 432-446.
Recuperado de https://doi.org/10.1007/s12975-013-0257-2
Gascón Castillo, M. L. (2017). Hemorragia
Subaracnoidea: Factores Predictores de Mala Evolución al Alta y a los 10 años
(Tesis propuesta para la obtención del grado de Doctor en Medicina y Cirugía).
Universidad de Sevilla, España. Recuperado de https://dialnet.unirioja.es/servlet/tesis?codigo=147224
González Aguirre,
Y., Varela Hernández, A., Casares Albernas, F., Herrera Lorenzo, O., Infante Ferrer,
J., Morgado Castañeda, R. (2012). Comportamiento de la hemorragia subaracnoidea
espontánea en el Hospital Universitario Manuel Ascunce Domenéch·. Revista
Cubana Neurología y Neurocirugía; 2(1). Recuperado de http://www.revneuro.sld.cu/index.php/neu/article/view/32
Greving, J. P., Wermer,
M. J., Brown, R. D., Jr, Morita,
A., Juvela, S.,
Yonekura, M., et al. (2014). Development of the PHASES score for prediction of
risk of rupture of intracranial aneurysms: a pooled analysis of six prospective
cohort studies. Lancet Neurology, 13(1), 59-66. Recuperado de https://doi.org/10.1016/S1474-4422(13)70263-1
Gritti, P.,
Akeju, O.,
Lorini, F. L.,
Lanterna, L. A.,
Brembilla, C.
& Bilotta, F. A. (Julio,
2018). Narrative Review of Adherence to Subarachnoid Hemorrhage Guidelines. J
Neurosurg Anesthesiology, 30(3), 203-216. Recuperado
de https://doi:10.1097/ANA.0000000000000453
2001. http://www.rmu.org.uy/revista/2001v2/art5.pdf
Hall, A. & O'Kane, R. (Jan, 2018). The Extracranial
Consequences of Subarachnoid Hemorrhage. World
Neurosurg, (109), 381-392. Recuperado de https://doi:10.1016/j.wneu.2017.10.016
Heuschmann, P.U.,
Di Carlo, A., Bejot, Y., Rastenyte, D., Ryglewicz, D., Sarti, C., et al.,
(2009). Incidence of stroke in Europe at the beginning of the 21st century. Stroke.
European Registers of Stroke (EROS). Investigators, 40(5), 1557-1563.
Recuperado de https://doi:10.1161/STROKEAHA.108.535088
Huilca Flores, J.C. y
Betancourt Nápoles, R. (2016). Factores de mal pronóstico
en pacientes con hemorragia subaracnoidea espontánea atendidos en el Hospital
Universitario “Manuel Ascunce Domenéch”. Revista Cubana de Neurología y
Neurocirugía, 6(1), 1–8. Recuperado de http://www.sld.cu/sitios/neurocuba
Ingelmo Cereceda, N. (2015).
Incidencia y factores asociados a la hemorragia intracraneal (Tesis doctoral).
Universidad del País Vasco. España. Recuperado de https://addi.ehu.es/handle/10810/16007
Jiménez Leal, P.F.
(2017). Complicaciones y secuelas en pacientes con Hemorragia Subaracnoidea,
estudio a realizarse en el Hospital Universitario de Guayaquil Año 2014 – 2015
(Trabajo de Titulación presentado como requisito para optar el Título de Médico).
Universidad de Guayaquil, Guayaquil, Ecuador. Recuperado de http://repositorio.ug.edu.ec/bitstream/redug/32287/1/CD%201757-%20JIMENEZ%20LEAL%20PETER%20FRANK.pdf
Kaptain, G. J., Lanzino, G.
& Kassell N. F.
(Sep., 2000). Subarachnoid haemorrhage: epidemiology,
risk factors, and treatment options. Drugs Aging,
17(3), 183-199. Recuperado de https://doi:10.2165/00002512-200017030-00003
Khoujah, D.,
Chang, W.W.
& Abraham M. K. (dec.,
2017). The neurology literature 2016. American Journal of Emergency Medicine
35(12), 1934-1939. https://doi:10.1016/j.ajem.2017.08.060
Linares Cristobal, J.J. (2018).
Causas no traumáticas en hemorragia intracraneal en pacientes hospitalizados
en el Hospital Nacional “Sergio E. Bernales” en el período enero-diciembre
2017. (Tesis presentada para optar el Título Profesional de Médico Cirujano). Universidad
Privada San Juan Bautista. Lima, Perú. Recuperado de http://repositorio.upsjb.edu.pe/bitstream/handle/upsjb/1551/T-TPMC-%20Jorge%20Jefferson%20%20Linares%20Cristobal.pdf?sequence=1&isAllowed=y
Macdonald,
R. L. (2014). Delayed neurological deterioration after subarachnoid hemorrhage.
Nature Reviews Neurology 10(1), 44-58. Recuperado
de https://doi.org/10.1038/nrneurol.2013.246
Macdonald R. L.
& Schweizer, T. A. (Feb.,
2017). Spontaneous subarachnoid hemorrhage. Lancet 11, 389(10069),
655-666. Recuperado de https://doi:10.1016/S0140-6736(16)30668-7
Meurer, W. J.,
Walsh, B.,
Vilke, G. M.
& Coyne, C. J. (Apr.,
2016). Clinical Guidelines for the Emergency Department Evaluation of
Subarachnoid Hemorrhage. Journal of Emergency Medicine, 50(4), 696-701. Recuperado
de https://doi:10.1016/j.jemermed.2015.07.048
Milinis, K. Thapar,
A. O’Neill, K. Huw & Davies, A. (2017). History of Aneurysmal Spontaneous
Subarachnoid Hemorrhage. Stroke, (48), 280-283.
Recuperado
de https://doi:10.1161/STROKEAHA.117.017282
Millán Cordoví, E., de la
Cruz Calderon Walters, J., Amat Puig J., Negreira Ochoa, D., Millán Montes de
Oca, E. H. (2014). Caracterización de la evaluación y tratamiento de las
enfermedades cerebrovasculares en el Hospital “Guillermo Domínguez López”. Revista
Electrónica Dr. “Zoilo E. Marinello Vidaurreta”, 39(10), 1-7. Recuperado
de http://revzoilomarinello.sld.cu/index.php/zmv/article/view/145/256
Ministerio de Salud Pública.
(2018). Anuario Estadístico de Salud 2017. La Habana, Cuba. Recuperado
de http://www.sld.cu/sitios/dne/http://bvscuba.sld.cu/anuario-estadistico-de-cuba/
Misis
del Campo, M. T. (2014). Factores
pronósticos de la evolución en la hemorragia cerebral espontánea (Tesis doctoral). Universidad Autónoma de
Barcelona, España. Recuperado de https://www.tesisenred.net/bitstream/handle/10803/283882/mtmdc1de1.pdf?sequence=1&isAllowed=y
Nieuwkamp, D. J.,
Rinkel, G. J, Silva, R., Greebe, P., Schokking, D. A. & Ferro,
J. M. (2006). Subarachnoid haemorrhage in patients >75 years: Clinical
course, treatment and outcome. Journal of Neurology, Neurosurgery and
Psychiatry, 77(8), 933-937. Recuperado
de https://doi.org/10.1136/jnnp.2005.084350
Palacios Gómez,
N. T. (2018). Caracterización clínica y factores de riesgo asociados a eventos
cerebrovasculares agudos (Trabajo de Titulación presentada para optar por
el Título de Médico). Universidad de Guayaquil. Guayaquil, Ecuador. Recuperado
de http://repositorio.ug.edu.ec/bitstream/redug/31341/1/CD%202523-%20PALACIOS%20GOMEZ%20NANCY%20TATIANA.pdf
Palacios Mendoza, M. Briones
Figueroa, A. y Vásquez Cedeño, D. (2014). Validación de diferentes escalas en
la evaluación del pronóstico de pacientes con Hemorragia Subaracnoidea
Espontánea en el Hospital Regional Dr. “Teodoro Maldonado Carbo” entre
mayo-2011 y mayo-2014. Revista Ecuatoriana de Neurología, 23(1-3),
24-28. Recuperado de http://revecuatneurol.com/wp-content/uploads/2016/01/Validacio%CC%81n-de-diferentes-escalas_REN-Vol-23-N%C2%BA1-3-2014-3.pdf
Pérez Nellar,
J., Scherle Matamoros, C., Gil Alfonso, M., González González, J. &
Hierro García, D. (2014). Hemorragia subaracnoidea
no aneurismática. Revista Cubana de Medicina, 53(3), 310-324. http://scielo.sld.cu/pdf/med/v53n3/med08314.pdf
Rebanal
Poo, E. (2017). Hemorragia
Subaracnoidea Espontánea. Una enfermedad neurológica cada vez más común (Grado
en Enfermería). Universidad de Cantabria, España. Recuperado
de https://repositorio.unican.es/xmlui/bitstream/handle/10902/11614/Rebanal%20Poo%20Irene.pdf?sequence=4
Scherle Matamoros, C. A.,
Pérez Néllar, J., Roselló Silva, H., Cutiño Maas, Y., Amaro Hernández, A. y
Matos, J. L. (2007). Hemorragia subaracnoidea. Diagnóstico y seguimiento del
vasoespasmo por doppler transcraneal. Revista Cubana de Medicina Intensiva y
Emergencia, 6(1), 624-632. Recuperado de http://www.bvs.sld.cu/revistas/mie/vol6_1_07/mie05107.pdf
Suárez J., Tarr
R. y Selman, W. (2006). Aneurysmal
subarachnoid hemorrhage. New England Journal of Medicine, (9), 354-387. Recuperado
de https://www.nejm.org/doi/full/10.1056/NEJMra052732
Van Gijn, J.,
Kerr, R. S. &
Rinkel, G. J. (Jan,
2007). Subarachnoid haemorrhage. Lancet 27, 369(9558). 306-318.
Varona Miyares, I., Cabrera
Figueredo, I. y Rodríguez Yanes, E. (2016). Morbimortalidad por hemorragia
subaracnoidea en el Hospital Universitario “Manuel Ascunce Domenech”. Revista
16 de abril. Recuperado de http://www.16deabril.sld.cu/rev/252/ao05.html
Vivancos, J., Gilo, F., Frutos, R., Maestre,
J., García Pastor, A. y Quintana, F., et al. (2014). Guía de actuación clínica
en la hemorragia subaracnoidea. Sistemática diagnóstica y tratamiento. Neurología,
29(6), 353-370. Recuperado de http://dx.doi.org/10.1016/j.nrl.2012.07.009